業務案内
- Home
- 業務案内
- リスク評価・SDS作成・規制対応
- 予測方法の概要
予測方法の概要
化学物質の性質を予測する方法には、大きく分けて、(Q)SARによる方法と、Read-acrossによる方法があります。
■(Q)SAR
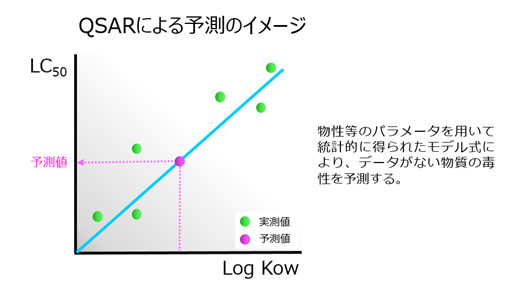
(Q)SAR1)とは、構造的に類似した物質の既知の活性に基づいて、試験を実施することなく評価対象物質の活性を予測することです。統計学的手法等により構築されたモデル式を用いた統計ベースによる予測(例:Case Ultra2)、EcoSAR3))や専門家判断による警告構造4)を用いた知識ベースによる予測(例:Derek Nexus5))があります。
1) Quantitative Structure-Activity Relationships(定量的)構造活性相関
2) 米国MultiCASE社が開発した有償の統計ベースの予測モデル (一部知識ベースのモデルも含む)
3) 米国EPAにより開発された生態毒性に関する無償の統計ベースの予測モデル
4) 毒性の発現に寄与する官能基や部分構造
5) 英国Lhasa社が開発した有償の知識ベースの予測モデル (一部統計ベースのモデルも含む)
■ Read-across
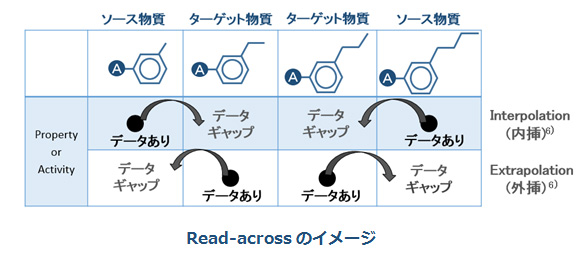
Read-acrossとは、予測を行いたい物質(ターゲット物質)に対して類似性のある物質(ソース物質)のデータを用いて、予測を行いたい物質の毒性等のエンドポイントのデータギャップの穴埋めを行う方法です。Read-acrossは、(Q)SARが適用できないエンドポイントや物質群に対して有効な方法です。
-
6) ターゲット物質がソース物質の間にある場合を内挿 (Interpolation) といい、ターゲット物質がソース物質の片側にしかない場合を外挿 (extrapolation) という。一般的に、内挿による予測が推奨される。
■ 国内外での活用の動向
・医薬品の変異原性不純物の評価においては、Ames試験の代替として、2種類の相補的な(Q)SARによる予測が認められています。
・化粧品業界などを中心に、皮膚感作性に関するin vitro試験と(Q)SAR等の代替法を組み合わせた皮膚感作性の評価がOECDで検討されています。
・欧州の化学品規制であるREACH規則、米国におけるTSCA等の制度では、(Q)SARやRead-acrossにより得られたデータを登録や申請に使用することができます。
・EFSA (欧州食品安全機関)やFDA(米国食品医薬品局)は (Q)SAR等の手法を積極的に利用しています。
・GHS分類のうち、生殖細胞変異原性や水生環境有害性等の一部の項目において、(Q)SARを用いた予測結果によって分類に対する証拠の重み付けを行うことができます。
・日本国内では、企業における化学物質の自主管理において使用されており、JIPS(Japan Initiative of Product Stewardship)では、積極的な活用が推奨されています。
■CERIが実施する予測の特徴
予測による評価は、用いる(Q)SARモデルによって、結果が異なってくることもあり、得られた予測結果をどのように解釈すべきか悩むことがあります。CERIの実施する予測では、予測結果に対して、OECD原則等に基づいて国際的に整備されてきた方法を参考にした信頼性評価を行うとともに、得られたデータの解釈までサポートいたします。また、Read-acrossについても評価に係る情報収集や構造以外の観点からの類似性を考慮した評価を行います。
OECD原則
(Q)SARモデルを規制に利用することを目的した場合に、そのモデルが満たすべき5原則(1)エンドポイントの定義
(2)曖昧ではないアルゴリズムの定義
(3)適用範囲の定義
(4)適合性、頑健性、予測性の適切な評価
(5)可能ならば、メカニズムに関する解釈