業務案内
- Home
- 業務案内
- 医薬品・医療機器の試験・評価
- 高分子医療機器の劣化生成物(ISO 10993-13)
高分子医療機器の劣化生成物(ISO 10993-13)
高分子医療機器の劣化生成物(ISO 10993-13)
ISO 10993-13に基づいて、高分子製医療機器の劣化生成物の評価を実施しています。
医療機器の製造販売承認申請等で添付すべき資料のうち、生物学的安全性評価に関する資料の取扱いについては、令和2年1月6日に薬生機審発0106第1号でガイドラインが示されました。そのガイドラインでは、ISO 10993-1(JIS T 0993-1)に準拠して評価項目を選定することが求められており、リスクアセスメントに先立ち、高分子の分解生成物についてはISO 10993-13を参照と示されています。
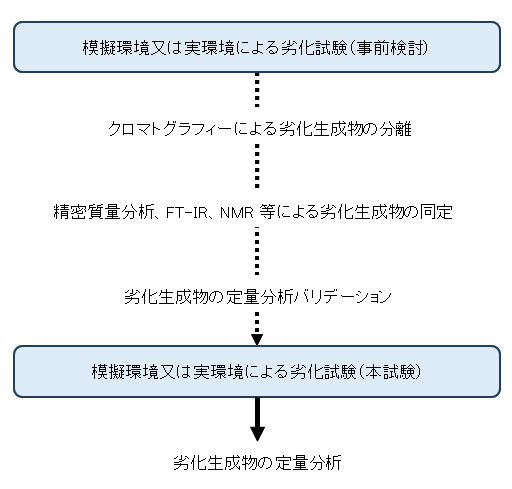
ISO 10993-13ではインプラント等に使用される高分子製品について、加水分解や酸化劣化を想定した加速劣化をスクリーニング試験として実施し、その後必要に応じて実時間劣化試験を行うフローに従って評価を行います。試験において、物質収支や分子量に変化が認められた場合、劣化生成物の同定、定量化が求められます。劣化生成物はモノマーやオリゴマー等が想定され、それらの化合物構造に基づき、適切な分析法を選択する必要があります。
通常、劣化生成物は単一物質ではなく、複数の化合物が生じます。まずは、高分子の主鎖骨格・末端の構造を把握し、さらには過去の知見や文献調査に基づき、分解機構に関するメカニズムに関する情報を収集します。これらの情報を基に、複数の分析法を組み合わせて未知化合物の構造を同定するため解析を実施します。